
Африканська чума свиней (АЧС) - Загальна інформація
Африканська чума свиней (АЧС) – хвороба, на яку хворіють домашні та свійські свині. Хоча вірус нешкідливий для людей, він може бути смертельним для свиней і мати серйозні соціально-економічні наслідки для постраждалих країн. В останні роки хвороба поширилася по Європі, в період з 2016 по 2020 рік було втрачено 1,6 млн. свійських свиней внаслідок вірусу. Оскільки ліків чи вакцини наразі немає, важливо запобігати спалахам, вживаючи відповідних заходів як громадянин, турист, фермер чи мисливець. У зонах спалахів масовий забій свиней і кабанів, які утримуються на фермах, наразі є єдиним ефективним способом запобігання поширенню на прилеглі регіони та країни. Таким чином, раннє виявлення, профілактика та звітність мають вирішальне значення, якщо ми хочемо контролювати цю епідемію. Цей веб-сайт містить матеріали, які дають загальне уявлення про африканську чуму свиней та її ознаки у інфікованих свиней. Ресурси містять інформацію про те, що робити, якщо ви виявили підозру на АЧС, яких заходів вжити та до кого звернутися, якщо ви фермер/мисливець чи ветеринар. Важливо вчасно виявити ознаки аби запобігти поширенню.
Вакцини проти африканської чуми свиней (АЧС) немає, тому спалах може призвести до забою великої кількості свиней, які утримуються на фермах, у постраждалій місцевості. Оскільки спалах АЧС може мати такі руйнівні наслідки, виявлення, запобігання та звітування є ключовими для стримування цієї смертельної хвороби.
Африканська чума свиней нешкідлива для людей, але райони, уражені АЧС, зазнають значних фінансових втрат через обмеження експорту м’яса.
Важливо вміти виявляти симптоми, якщо ваші свині мають будь-які з наведених нижче ознак, будь ласка, зверніться до місцевого ветеринара:
- лихоманка;
- втрата апетиту/ваги;
- загальна слабкість;
- блювота;
- діарея;
- почервоніння шкіри.
Для того, щоб запобігати поширенню, потрібно дотримуватися наступних правил:
- зберігати чистоту одягу та взуття перед відвідуванням тварин;
- дезінфікувати обладнання;
- забезпечити надійну огорожу, щоб запобігти проникненню кабана до вашого господарства;
- перевіряти джерела надходження кормів та свиней.
З часу першого опису АЧС на початку двадцятого століття вірус АЧС циркулював у різних частинах світу, де він є ендемічним (Африка) або спричиняв повторні спалахи на інших територіях. Дослідження вірусу слідкували за цими тенденціями відповідно до кожного спалаху, досягнувши піку публікацій безпосередньо перед недавнім спалахом у 2007 році. Нещодавні відкриття у фундаментальній вірусології з особливим акцентом спрямовані на протеомний аналіз, цикл реплікації та деяких нещодавніх даних про гени, що беруть участь у прогресуванні циклу та взаємодії вірус-інфікований, такі як EP402R (CD2v), I215L (E2 убіквітин-кон’югуючий фермент), A104R (гістоноподібний білок), QP509L, Q706L (РНК-гелікази) і P1192R (топоізомераза II). Враховуючи розміри цього вірусу та той факт, що його геном може варіюватися від 170 до 194 КБ в довжину, слід приділити більше зусиль базовим вірусологічним дослідженням у цілому вірусі, щоб кращн зрозуміти механізми, які використовуються вірусом у його циклі реплікації та його складній взаємодії з інфікованою твариною. Протеомні дослідження на даному етапі тільки почали шлях вивчення.
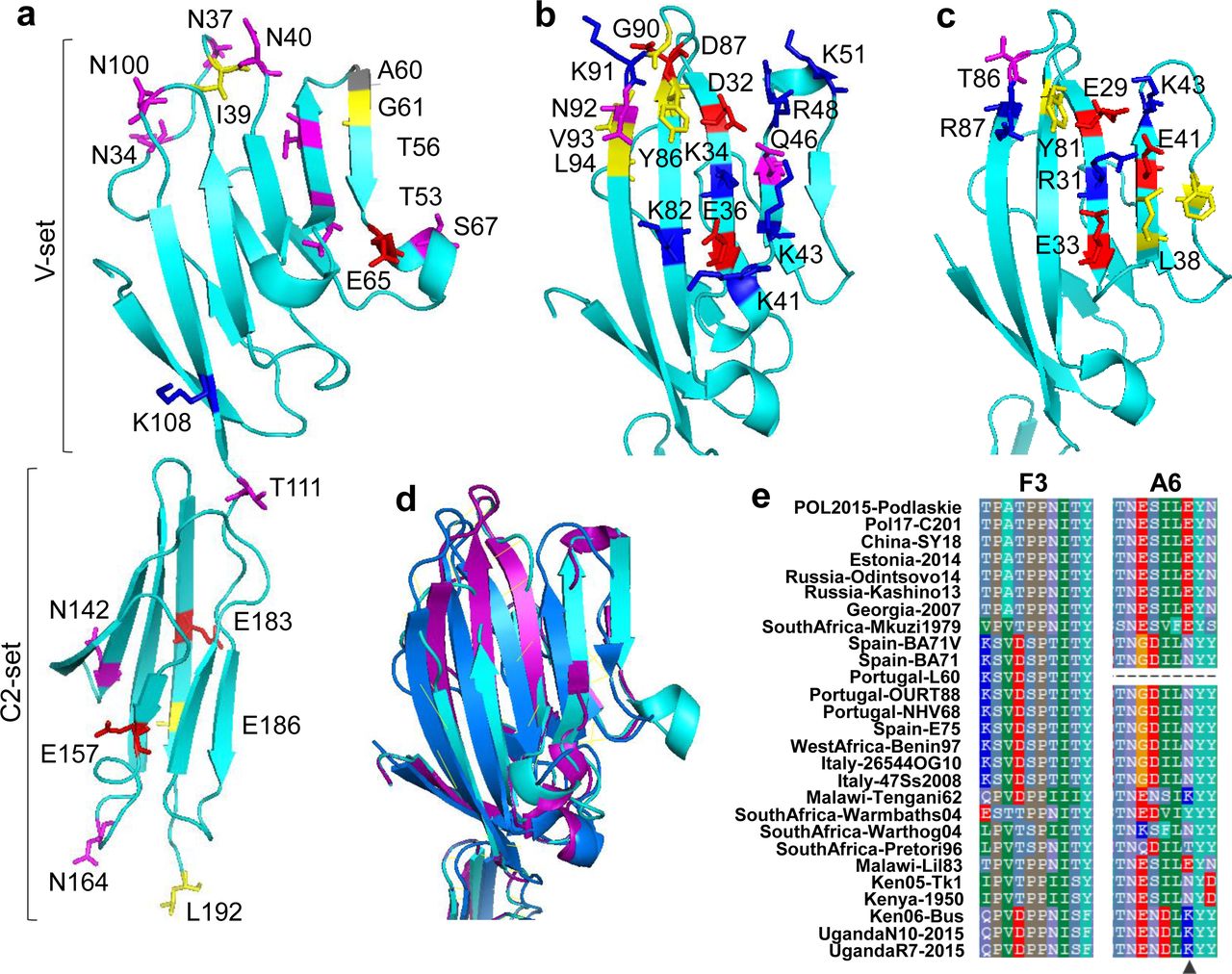
Структурне мапування позитивно відібраних сайтів вірусу EP402R і порівняння з ключовими сайтами в гомологах CD2.
(а) Позитивно відібрані сайти в EP402R зіставлені з модельованою структурою EP402R. Показано обидва домени C-set і V-set. (b) Сайти зв’язування ліганду CD2 людини, зіставлені з доменом V-set у структурі (PDB ID: 1hnf). (c) Сайти зв’язування ліганду CD2 щурів, картовані на домен V-set у структурі (PDB ID: 1hng). Місця зв’язування показано як кольорові фрагменти з позитивно зарядженими залишками синього кольору, негативно зарядженими залишками червоним, полярними залишками пурпурового кольору і гідрофобними залишками – жовтого. (d) Суперпозиція домену V-set структури EP402R, CD2 людини та CD2 щура. Три білки мають подібну доменну структуру V-set, утворюючи глобулярну складку з двома β-листами. (e) Два відомі епітопи F3 і A6 в EP402R демонструють високу відмінність між штамами ASFV. Позитивно вибраний сайт E157 в A6 позначено чорним трикутником. Штам Portugal-L60 має делецію в місці розташування A6. Усічення EP402R видаленими нуклеотидами в Portugal-OURT88 і Portugal-NHV68 було відновлено для отримання нормально трансльованих епітопних послідовностей.
Вірус АЧС є єдиним представником родини Asfarviridae. Процес встановлення та розробки методів генотипування вірусу АЧС пов’язаний із різною кількістю епідеміологічних доказів, згідно з якими ген використовується для відстеження вірусу в певному регіоні. На основі гена, що кодує p72 (B646L), ідентифіковано 24 генотипи вірусу АЧС. Всі 24 генотипи були зареєстровані в Африці, в основному поширені в Східній Африці та Південній Африці. Генотипи I і II поширені в Центральній Африці, а генотип I – в деяких країнах Західної Африки. У перших спалахах за межами Африки штами АЧС, які колись були поширені в 1960-х роках у країнах Західної Європи, а в 1970-х роках у країнах Карибського басейну та СРСР (тепер Україна), були викликані штамами генотипу I. Наприкінці минулого століття всі країни за межами Африки, крім Італії (зокрема Сардинії, де штами генотипу I залишалися ендемічними), ліквідували АЧС. Другий спалах за межами Африки відбувся 2007 року, і з тих пір вірус поширився на великих територіях Росії, Східної Європи, Китаю, Південно-Східної Азії, а нещодавно і в Домініканській Республіці та на Гаїті. Це було охарактеризовано як результат генотипу II штаму Georgia 2007. Однак, оскільки ген B646L (кодує p72) є відносно консервативним, генотипічні зміни зазвичай не відбуваються, коли штам є ендемічним у певному регіоні. Таким чином, генотипування p72 є кращим методом для ідентифікації походження вірусу АЧС у разі інтродукції на нові території, оскільки кластеризація генотипу p72 може бути використана, щоб допомогти відстежити джерело вірусу на молекулярному рівні та допомогти зрозуміти потенційні шляхи передачі. Інші генотипи, що базуються на CVR та IGR, можуть допомогти передбачити молекулярні епідеміологічні зміни та еволюцію АЧС, оскільки відмінності більш значні. Наприклад, послідовність IGR першого штаму вірусу у китайських диких кабанів (China/Jilin/2018/boar, GenBank номер доступу MK189457) має 10 делецій основ порівняно з поширеним штамом у китайських свиней (GenBank номер доступу MH735144), припускаючи, що цей штам може мати інше походження. Проте беззаперечним є те, що швидка поява варіантних штамів вірусу АЧС з різними послідовностями IGR могла відбутися за короткий проміжок часу та з симпатричним розподілом.
Метод серотипування, заснований на секвенуванні сигнатур лектину CD2v/C-типу, дозволяє краще диференціювати біологічно релевантні фенотипи порівняно з генотипуванням p72. Це буде більш корисним у вивченні різноманітності та антигенної мінливості штамів АЧС, а також надасть ключову інформацію для розробки вакцини. Вважається, що завдяки безперервному поглибленому вивченню геномів вірусу АЧС і технології типування, особливо секвенування повного генома та експериментальних даних із перехресного захисту, ми зможемо отримати більш чітке розуміння еволюції вірусу АЧС.
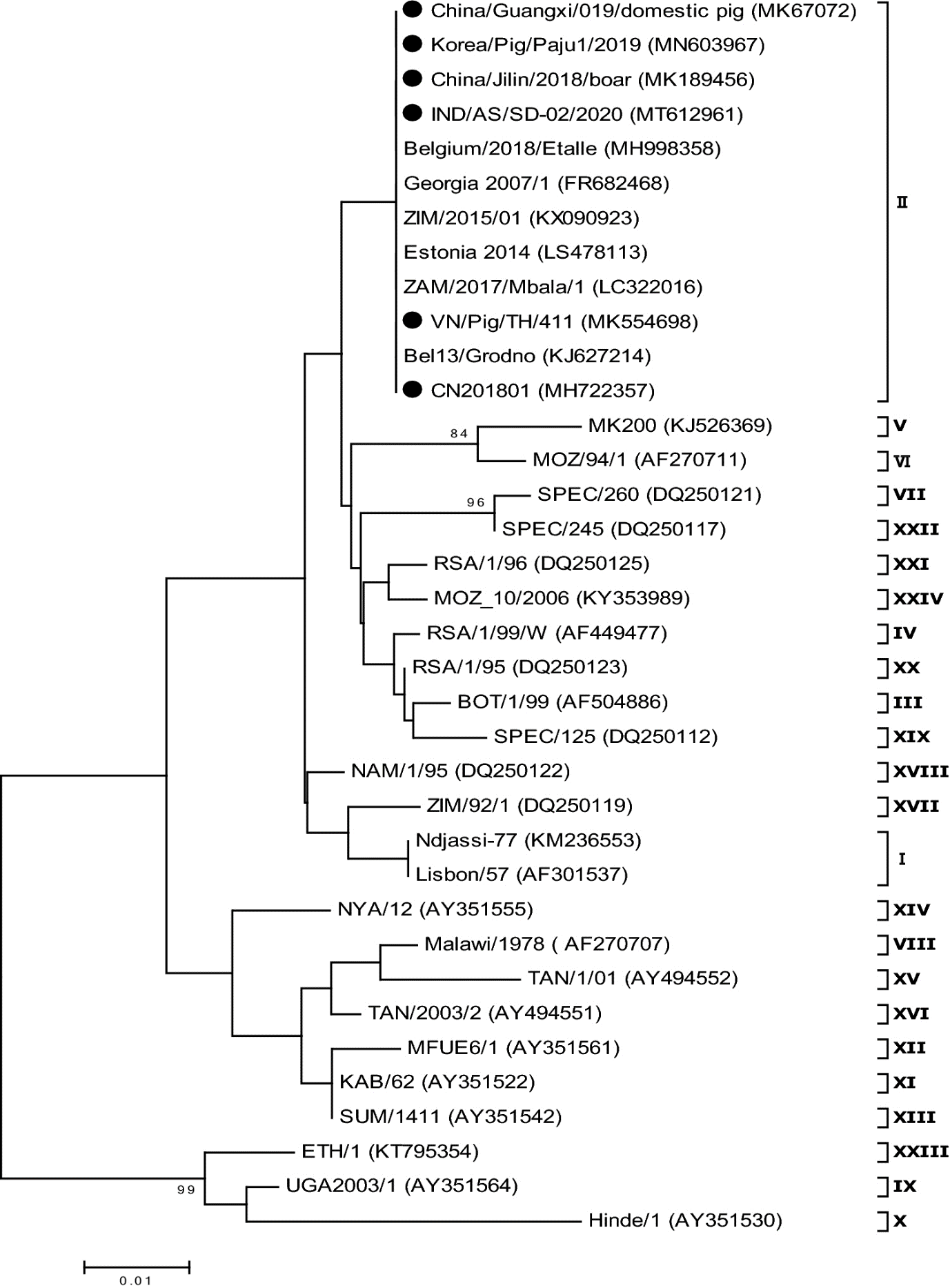
Еволюційні спорідненості штамів вірусу африканської чуми свиней (АЧС) на основі послідовностей генів p72 (B646L). Філогенетичне дерево було зроблено за допомогою методу максимальної правдоподібності та 2-параметричної моделі Кімури на основі часткових нуклеотидних послідовностей гена B646L. Філогенізм було зроблено з використанням 1000 реплікацій початкового завантаження, а значення вузлів показують відсоток підтримки початкового завантаження (показано лише значення > 80%). Масштабна шкала показує кількість замін на сайт. Послідовності азійських ізолятів АЧС позначено колом (●)
Вважається, що вірус походить від вірусу м’якого кліща (рід Ornithodoros), який інфікує диких свиней, у тому числі гігантських лісових свиней (Hylochoerus meinertzhageni), бородавочників (Phacochoerus africanus) і кущових свиней (Potamochoerus porcus). У цих диких господарів інфекція зазвичай протікає безсимптомно. Вірус виник приблизно в 1700 році нашої ери.
Ця дата підтверджується історичними даними. Свині спочатку були одомашнені в Північній Африці та Євразії. Вони були завезені в південну Африку з Європи та Далекого Сходу португальцями (300 років тому) та китайцями (600 років тому) відповідно. Наприкінці 19 століття широке свинарство в рідному регіоні АЧС (Кенія) почалося після масових втрат великої рогатої худоби через спалах чуми великої рогатої худоби. Свині були імпортовані в масових масштабах для розведення колонізаторами з Сейшельських островів у 1904 році та з Англії в 1905 році. У той час свинарство було вільним. Перший спалах АЧС був зареєстрований у 1907 році.
Африканська чума свиней (АЧС) є однією з найважливіших транскордонних хвороб свиней, яка спричиняє обмеження торгівлі та негативно впливає на здоров’я свиней. Країни Європи постраждали від АЧС з 2014 по 2018 роки, і вона продовжує поширюватися, незважаючи на зусилля з її контролю. Протягом років ми спостерігаємо високі показники смертності диких кабанів, знайдених мертвими, особливо на нових заражених територіях, що характерно для надгострої та гострої форм інфекції на початку епідемії АЧС. Експериментальні дані з циркулюючими штамами вказують на те, що деякі інфіковані тварини можуть залишатися безсимптомними і навіть пережити інфекцію. Підвищена присутність вірусу помірної вірулентності може ускладнити діагностику АЧС, а також пом’якшення та контроль хвороби. Аналіз даних нагляду за АЧС у диких кабанів країнах ЄС, де АЧС була присутня довше, порівнюючи просторову щільність позитивних повідомлень про антитіла з часом присутності АЧС у кожному регіоні, свідчить про збільшення щорічного розподілу повідомлень на основі антитіл над виявленням нуклеїнових кислот у впольованих кабанів, які пережили більш гострі форми у 2017 та 2018 роках. Загалом спостерігалася позитивна статистична кореляція між часом інфікування і позитивною щільністю антитіл, з деякими варіаціями в певних регіонах. Тенденція до збільшення кількості потенційних вижилих (впольовані кабани з підтвердженим негативним результатом ПЛР і позитивними результатами на антитіла) посилює важливість плану спостереження для відбору зразків і тестування відстріляного кабана. На завершення, дані епіднагляду, засновані на виявленні вірусу АЧС за допомогою ПЛР і серології, можуть бути використані для оцінки стану епідемії у диких кабанів.
Фактично вірус АЧС є єдиним у своєму роді і не має відомих «близьких родичів». Це єдиний вид у роду Asfivirus, родині Asfarviridae та порядку Asfuvirales. Кожен із цих трьох таксонів принаймні частково названо на честь АЧС.
Oзнаки та симптоми АЧС:
- Висока температура
- Зниження апетиту і слабкість
- Червоні/плямисті ураження шкіри
- Діарея, блювання
- Кашель
- Утруднене дихання
Вірус АЧС надійно діагностують за допомогою лабораторних методик
ПЛР: діагноз АЧС зазвичай підтверджується позитивним тестом на нуклеїнову кислоту та виключенням інших поширених причин подібних уражень. Найпоширенішим є ПЛР на ген Р72. Легені (бажаний зразок у лабораторії), нирки, селезінка, лімфатичні вузли, сироватка та кров є чудовими тестовими зразками для ПЛР. Оральні мазки та ротові рідини надзвичайно популярні, але кількість вірусу на кілька порядків менша, ніж у крові та тканинах, тому хибнонегативні результати досить поширені. Для тестування використовуються флуоресцентна кПЛР і ПЛР. ПЛР пропонує зручний шлях до секвенування генів.
Якщо вакцина з видаленим геном була використана навмисно або варіант штаму вірусу з видаленим геном був введений випадково, тестування нуклеїнової кислоти може виявитися невдалим у деяких тварин, оскільки кількість утвореного вірусу набагато нижча порівняно з польовим вірусом дикого типу. Однак, якщо доступні хороші зразки тканини або крові, можна провести тест нуклеїнової кислоти на видалені гени вакцинного вірусу. Після позитивного результату тесту на ген P72 можна провести ПЛР-тест для вакцини з видаленим геном на наявність ДНК з MGF 360 – 505 R і CD2v, щоб визначити, чи є проблемний вірус польовим вірусом чи вірусом вакцини з видаленим геном.
Петльова опосередкована ізотермічна ампліфікація (LAMP) пропонує швидку, дешеву, гнучку та надзвичайно чутливу альтернативу нуклеїнової кислоти, яка потребує небагато спеціалізованого обладнання та добре підходить для масового тестування, такого як моніторинг/скринінг при забої.
Серологія може бути використана, щоб визначити, чи контактували тварини з вірусом АЧС, якщо проміжок часу від зараження до тестування був достатньо довгим, щоб період віремії та присутності вірусу в тканинах минув, або якщо зразки розтину не отримані.
Для визначення наявності антитіл до P72, P30 та інших антигенів АЧС доступна низка наборів ELISA. Такі набори тестів часто використовуються для ідентифікації.
Існує картковий тест ELISA із захопленням антигену, але він має недостатню чутливість, і його використання зазвичай обмежується тими випадками, коли бажаний швидкий результат.
1 червня 2022 року у В’єтнамі успішно виготовлено першу вакцину проти африканської чуми свиней. На етапі розробки експериментальна вакцина проти ізоляту Джорджії 2007 року, який зараз циркулює, атенуйований видаленням вірусного гена I177L.
Ретроспективно було визнано, що перший спалах стався в 1907 році після того, як у 1921 році в Кенії вперше було описано АЧС. Хвороба залишалася обмеженою в Африці до 1957 року, коли про неї повідомили в Лісабоні, Португалія. Наступний спалах стався в Португалії в 1960 році. Після цих початкових інтродукцій хвороба закріпилася на Піренейському півострові, а спорадичні спалахи виникали у Франції, Бельгії та інших європейських країнах протягом 1980-х років. І Іспанії, і Португалії вдалося викорінити хворобу до середини 1990-х років за допомогою політики забою.
АЧС перетнув Атлантичний океан, і повідомлялося про спалахи на деяких островах Карибського басейну, включаючи Еспаньолу (Домініканська Республіка та Гаїті). Таким чином, митниця та прикордонна служба США перебувають у стані підвищеної готовності, щоб запобігти будь-якому поширенню в США, яке завдало б мільярди доларів збитків галузі свинини в країні. Про великі спалахи АЧС в Африці регулярно повідомляють у Всесвітню організацію охорони здоров’я тварин.
У 2018 році вірус поширився в Азії, вразивши понад 10 відсотків загального поголів’я свиней у кількох країнах, що призвело до серйозних економічних втрат у свинарському секторі.
Поява АЧС за межами Африки збігається з часом появи СНІДу. Цей факт викликав певний інтерес до того, чи пов’язані ці два захворювання, і в 1986 році у виданні The Lancet з’явився звіт стосовно взаємозв’язку між цими хворобами. Проте усвідомлення того, що вірус імунодефіциту людини (ВІЛ) викликає СНІД, дискредитувало будь-який потенційний зв’язок з АЧС.

